
順天堂大学医学部循環器内科学講座
心血管カテーテル
岡崎 真也SHINYA OKAZAKI
検査・治療内容
※クリックすると該当項目の内容をご覧いただけます。
- 心臓
カテーテル検査 CAG・画像診断・心筋生検 - PCI 経皮的冠動脈インターベーション
- PTA 経皮的血管形成術
- TAVI/TAVR 経カテーテル的大動脈弁植え込み術
- Mitra Clip マイトラクリップ
- ASD, PDA, PFO, LAA Closure
心臓カテーテル検査
順天堂医院では年間約2000件の心臓カテーテル検査をおこなっております。
狭心症や心筋梗塞などの虚血性心疾患に対するカテーテル検査では、安全で質の高い冠動脈造影を行い、必要があれば冠血流予備量比(FFR)を追加で測定するなど、治療適応を慎重に判断しています。病変によっては、血管内超音波(IVUS)や光干渉断層法(OCT)で冠動脈を内側から観察し、プラークの性状も含めて検討します。冠攣縮が疑われる場合は、薬物による誘発試験もおこないます。心不全や肺高血圧症の患者さんには右心カテーテル検査で血行動態を把握し、心筋疾患が疑われる場合は積極的に心筋生検で原因精査を行なうなど、最善の治療につながる検査をおこなっています。
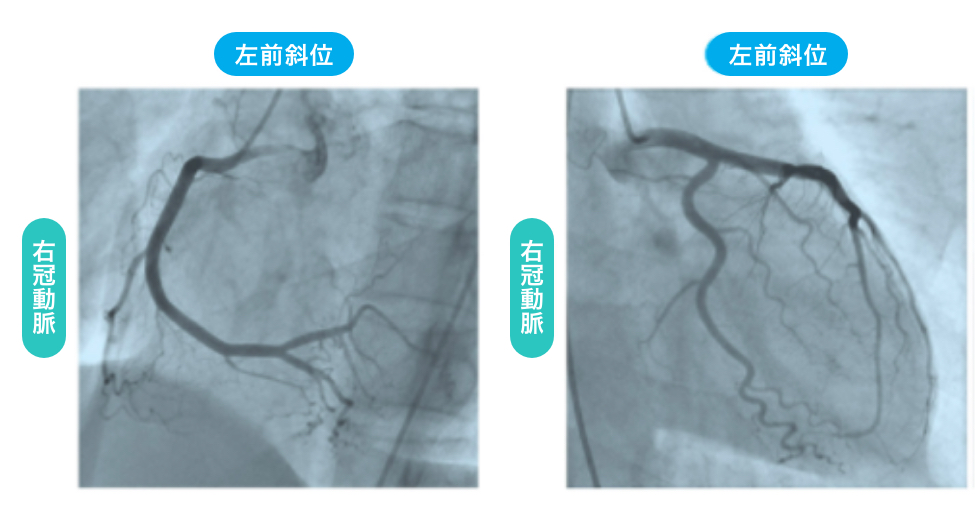
冠動脈造影(CAG)
カテーテルを橈骨動脈や上腕動脈または大腿動脈から挿入し、心臓の筋肉へ血液を供給している冠動脈の入口にカテ-テルを留置後に造影剤を注入して撮影し、狭窄・閉塞の有無を調べる検査です。
当院では、主に左橈骨動脈から検査を行っており、検査後すぐに歩行可能です。血管造影室には3種類の撮影装置を備えており、腎機能の悪い患者さんには2方向から同時撮影する装置を使用し少量の造影剤で検査を終えるようにしています。閉塞性動脈硬化症を合併している患者さんには、下肢の動脈造影を同時に行うことも可能です。
右心カテーテル検査
心機能の評価のため静脈にカテ-テルを挿入します。挿入部として、肘や頚部または足の付け根の静脈を使用します。挿入したカテーテルを用いて、右心房・右心室・肺動脈などの圧測定と心拍出量測定を行います。必要に応じて造影剤を注入し撮影を行います。
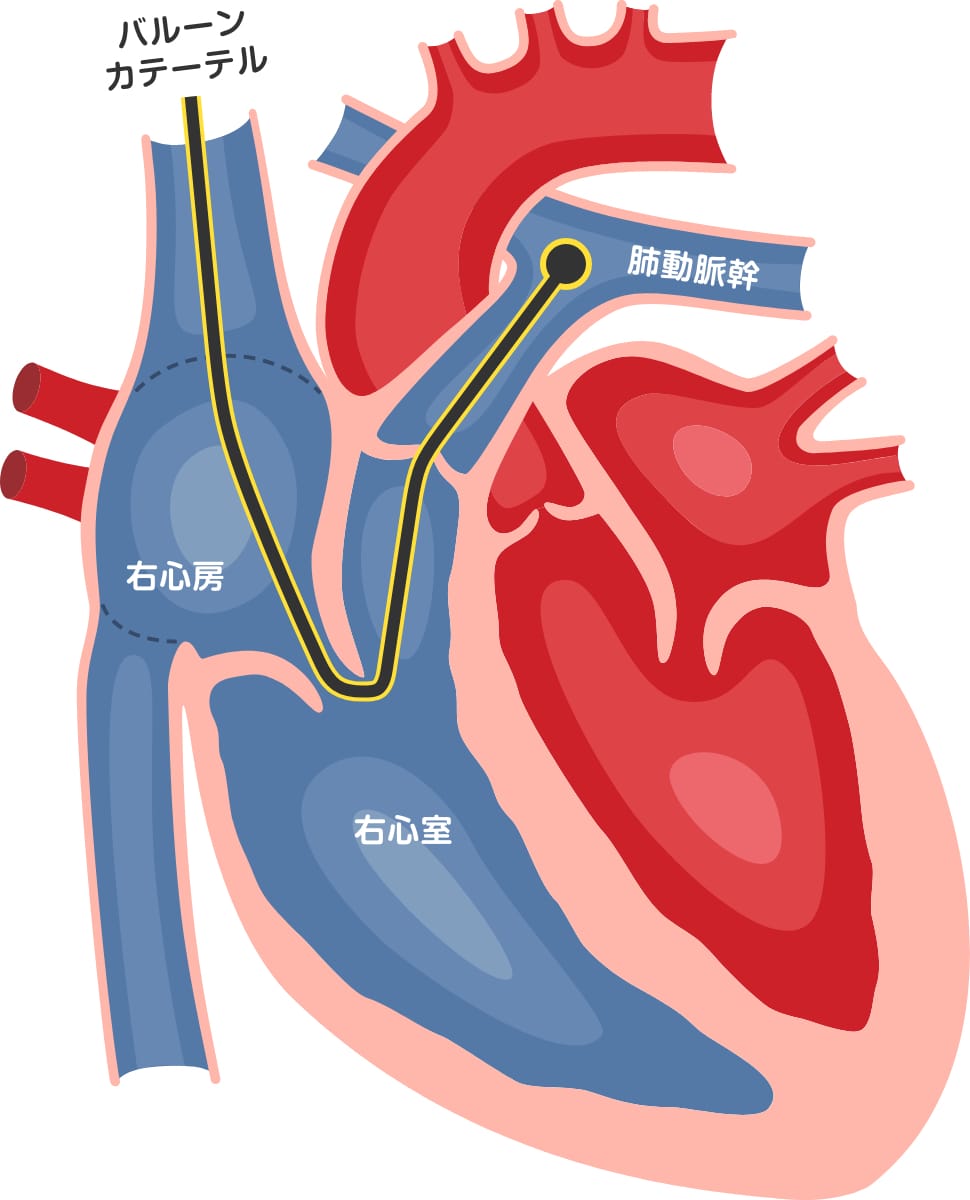
先端にバルーンの付いたカテーテルを静脈から挿入し、右心房→右心室→肺動脈に進めてそれぞれの圧測定を行います。必要により冷水を注入して拍出量を測定したり、造影剤を注入して、右室や肺動脈の状態を確認することがあります。
冠血流予備量比(FFR)
冠動脈内に狭窄病変があるとき、狭窄病変によってどのくらい血流が阻害されているかを推測する指標です。通常は冠動脈造影に続いて行います。心臓カテーテル検査による狭窄度から治療の必要性を判断します。また複数の狭窄病変がある場合には、治療の優先順位を判断することも可能です。冠動脈拡張剤(アデノシンやパパベリン、ニコランジルなど)を投与しながら、プレッシャーワイヤーを冠動脈に挿入してFFRを測定します。

冠血流予備量比 (FFR) とは
冠動脈狭窄病変がどれくらい重度かを知る指標です。
FFR は、冠動脈狭窄病変の近位部 (Pa) と遠位部 (Pd) の冠動脈内の圧を測定することで算出されます。(FFR = Pd ÷ Pa )
例えば、FFRが0.61の場合、重度狭窄病変があるために通常得られる最大血流量の61%しか得られていないことを意味します。遠位部のセンサーを病変部から引き抜くと圧格差がなくなり、病変が有意に血流を阻害していることが証明されます。
血管内超音波(IVUS)
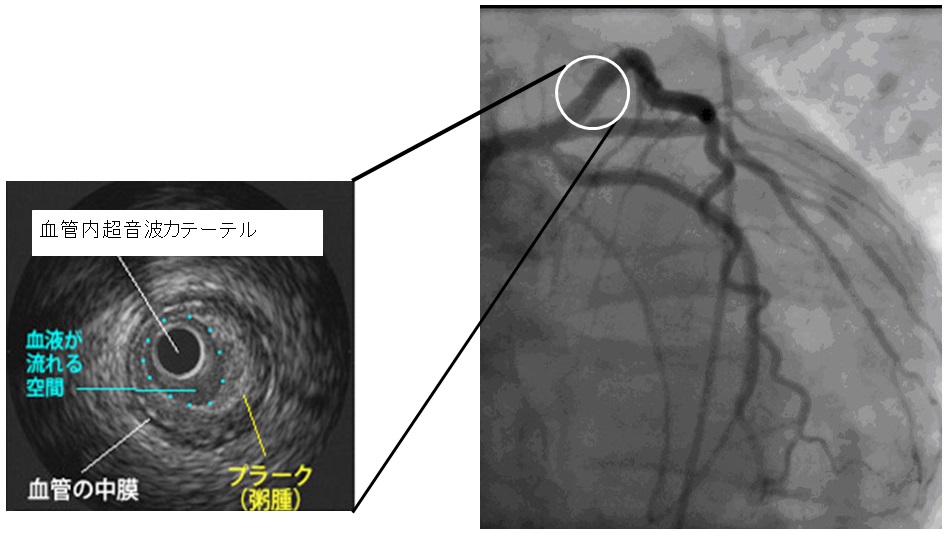
血管内超音波検査(IVUS)は超音波を用いて血管内部の断層画像をリアルタイムで見ることが出来る検査です。
一般的には経皮的冠動脈形成術(PCI)を施行する際に行われ、手技をより安全に確実におこなうためには欠かせない検査となっています。検査を通じて得られる血管内の情報は病態の把握や治療方針の決定に重要な役割を果たしています。具体的には径1mm弱の超音波送受信装置が先端に搭載された細いカテーテルを血管内に挿入することで血管内の情報が得られるというもので、手技に要する時間は短時間です。
血管内超音波(IVUS)について
冠動脈を輪切りにした画像が血管内超音波の画像です。
冠動脈造影で一見広いと思われた血管内にプラークの蓄積の蓄積が全周性に見られ、動脈硬化が進行している様子を示しています。
このように血管内超音波は造影より詳細な情報を与えてくれます。
光干渉断層法(OCT)
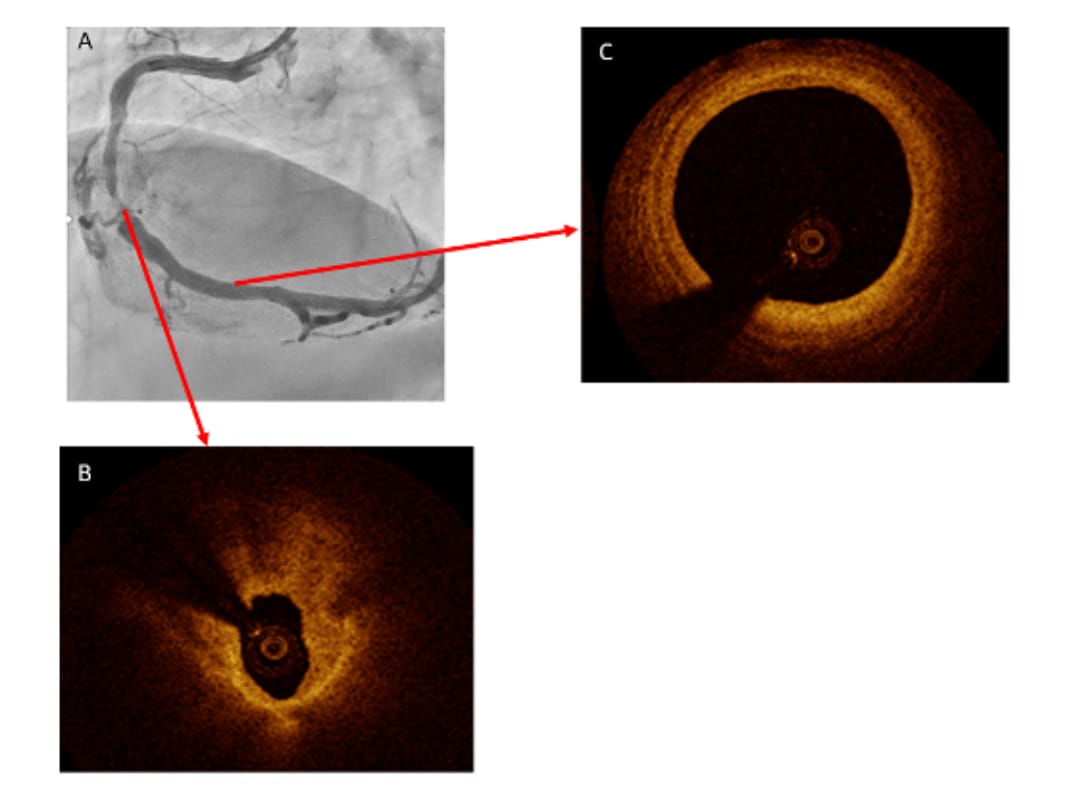
OCT(Optical Coherence Tomography:光干渉断層法)は、血管内超音波検査と同様に主に経皮的冠動脈形成術(PCI)を施行する際に行う検査の1つで冠動脈内の様子を詳細に評価出来る検査です。
OCTの特徴は血管内超音波検査(IVUS)と比べて解像度が約10-15μmとIVUSの約10倍の高い分解能を有し、IVUSの弱点である石灰化や血栓などの評価に優れています。
光干渉断層法(OCT)について
冠動脈造影(図A)にて右冠動脈に90%の狭窄を認めます。狭窄部のOCT画像(図B)では、わずかな石灰化と線維成分に富んだ動脈硬化病変を認めました。狭窄より末梢のOCT画像(図C)では、狭窄や動脈硬化は見られませんでした。
画像の解像度が良いため、血管壁の構造を血管内超音波より詳細に観察することができます。
心内膜心筋生検
心内膜心筋生検とは、拡張型心筋症・肥大型心筋症やその他の二次性心筋症など、心臓の筋肉の変性が疑われる場合に、心臓の筋肉の一部を採取し病理学的な検査(顕微鏡、免疫染色など)を行うことです。
心筋症は様々な原因によっておこり、その治療法も原疾患により違いますので、病理学的検査により治療方針の決定に重要な役割を果たしています。
心筋生検ではカテーテル検査時に静脈(左心室の場合は動脈)から生検鉗子(バイオトーム)とよばれる小さな鉗子を用いて、大きさ2-3 mmのわずかな心筋組織を採取します。
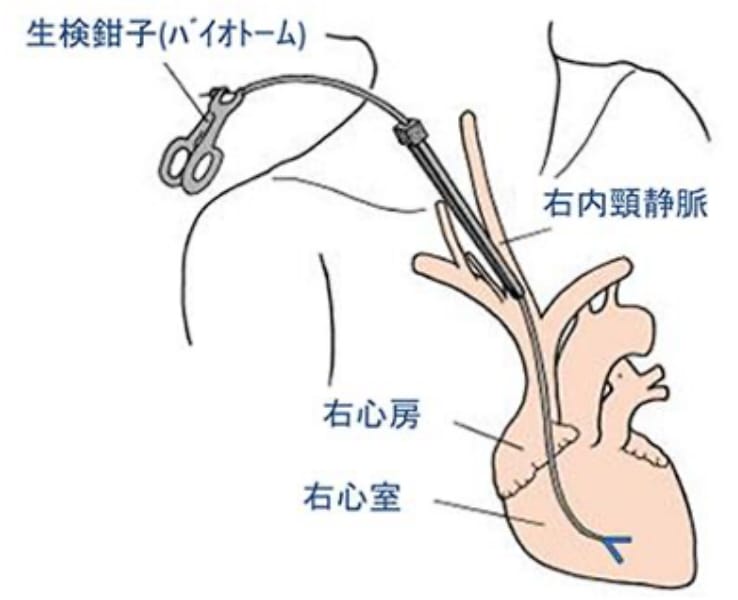
心内膜心筋生検について(右心心内膜生検の場合)
心内膜心筋生検では、心筋炎・サルコイドーシス・ファブリー病・アミロイドーシスなどの全身性疾患に伴う心疾患(二次性心筋症)を鑑別する他に、心臓移植後の免疫抑制剤の効果判定や治療方針の決定に関して重要な役割を果たすなどさまざまな役割を果たしています。
PCI(経皮的冠動脈インターベーション)
順天堂医院では年間約2000件の冠動脈造影および約500件の経皮的冠動脈インターベンション(PCI)を施行しており、全国でも有数の症例数となっています。それぞれの症例に対してディスカッションを行い、長期予後までを考慮して個々の症例で適切な治療法を検討しています。重症冠動脈疾患例や付随する弁膜疾患の修復など外科適応症例に関しては、最高の技術を持った当院心臓血管外科とカンファレンスを行い、症例に応じて外科治療を選択することもあります。急性心筋梗塞など緊急症例は年間約100例で、心肺停止など重篤な症例に対しても24時間体制で対応し、大動脈内バルーンパンピング(IABP)、 経皮的心肺補助装置(PCPS)などの循環補助下でのPCIも施行しています。
当院でのPCIは、通常左橈骨動脈アプローチを主体として施行するため、負担が少なく手術2時間後には歩行することが出来ます。(複雑病変や動脈の高度蛇行などで、下肢動脈アプローチを行う事も小数例ながらあります。)治療に際しては、個々の症例で適切なステントの種類を選択し、全身疾患を合併している患者さんには、他科との密接な連携によって、ステント留置の可否を含め最良の治療法を検討します。下記のとおり、様々なデバイスを適切に使用することで、カテーテル治療の弱点とされていた再狭窄率は年々低下し、2016年以降は再狭窄率5%未満を達成しています。更に、当科では全国的な治験にも数多く参加しており、新型の薬剤溶出型ステントなどを使用した最新治療も行っています。
薬剤溶出性ステント(DES)
ステントは小さな金属製の網状チューブで、永久的に冠動脈内にとどまり、血管壁を拡げた状態で支えて血流を確保します。
現在のインターベンション治療の主流となっており、再狭窄を防ぐ薬物がステントに塗ってある薬剤溶出性ステントを使用することがほとんどです。現在使用している薬剤溶出性ステントは、薬剤をステントに溶出させるために必要なポリマーが生体適合性の高いものに改良され、初期の薬剤溶出性ステントで問題となった血栓症のリスクは低下しました。当院ではポリマーを使用しないステントなど最新型の薬剤溶出性ステントを取り揃えており、病変に最も適したステントを選択して留置しております。

薬剤コーティングバルーン(DCB)
再狭窄抑制のための薬剤(パクリタキセル)がコーティングしてあるバルーン(DCB)です。
ステント内再狭窄、分岐部、小血管の病変や金属アレルギーの患者さんなどでは、ステント留置が好ましくない場合があります。
その際は薬剤溶出性バルーンを使用した治療を積極的に行っています。
冠動脈粥腫切除術(DCA)
冠動脈のプラークを鉋(かんな)のように削り取るデバイスで、特に偏心性に多量のプラークを有する病変に対して、病変部のプラーク量を減らす目的で使用します。また、分岐部病変において側枝の狭窄や閉塞の防ぐためにも有効であると考えられています。
ステント留置が好ましくない左主幹部の分岐部病変などには、DCA後に薬剤コーティングバルーンを組み合わせ、質の高いステントレス治療を行うことができます。

ロータブレーター、ダイアモンドバック360
透析患者や糖尿病患者に多く認められる高度石灰化病変では、留置後のステントの拡張が不十分になりやすく、再狭窄率が高いとされています。治療中にステントの通過が困難な症例もあります。
当院では石灰化病変の治療デバイスとして、先端にダイヤモンドチップを有し、高速回転して削りながら通過するロータブレーター(Boston Scientific社)と、ダイアモンドコートチップが円周上に回転し内腔を大きく削る事ができるダイアモンドバック360(Medikit社)の両方が使用可能です。石灰化の形態により2つのデバイスを使い分けており、石灰化病変に対する成績も向上させています。

慢性完全閉塞病変(CTO)
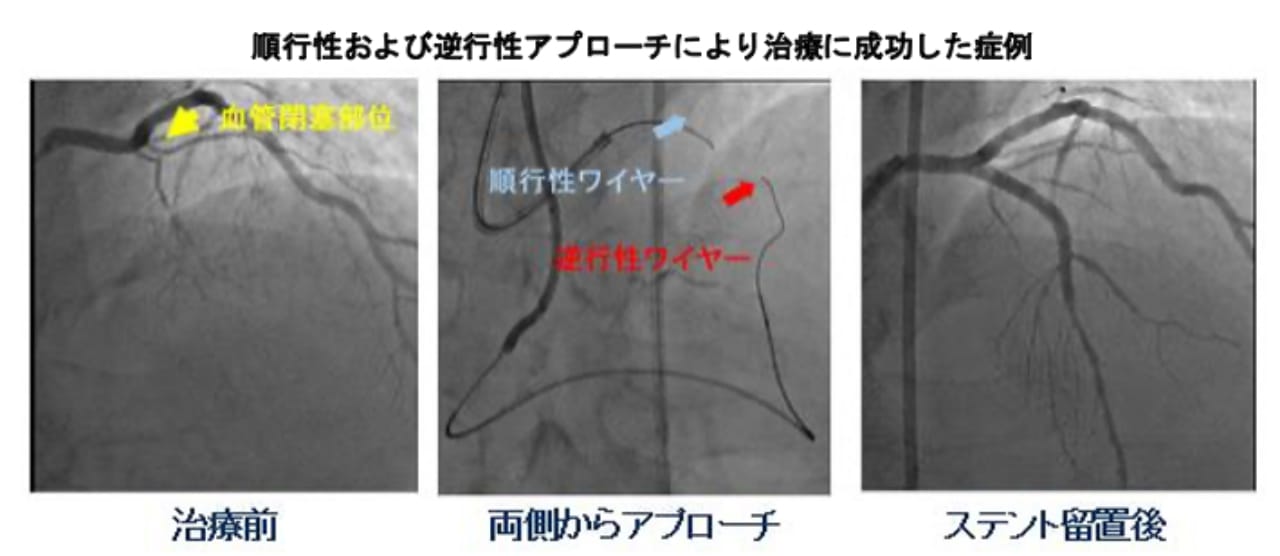
長期に渡り閉塞した血管は、硬くなり、通り道もわからないため、ワイヤー自体の通過が非常に困難であり、通常の狭窄部位の治療に比べて成功率が低いとされています。
当院では、優れた治療成功率と豊富な症例数を持つ術者のみが全国から選抜される、CTOレジストリーの登録医師がいるため、このような治療困難症例も他院よりご紹介いただき、多数施行しています。順行性のワイヤー通過が困難である場合は、積極的に逆行性アプローチを行うなどし、9割以上の高いCTO治療成功率に達しています。
PTA(経皮的血管形成術)
順天堂医院では年間約174件の経皮的血管形成術をおこなっております。
狭心症や心筋梗塞などの虚血性心疾患に対するカテーテル検査では、安全で質の高い冠動脈造影を行い、必要があれば冠血流予備量比(FFR)を追加で測定するなど、治療適応を慎重に判断しています。病変によっては、血管内超音波(IVUS)や光干渉断層法(OCT)で冠動脈を内側から観察し、プラークの性状も含めて検討します。冠攣縮が疑われる場合は、薬物による誘発試験もおこないます。心不全や肺高血圧症の患者さんには右心カテーテル検査で血行動態を把握し、心筋疾患が疑われる場合は積極的に心筋生検で原因精査を行なうなど、最善の治療につながる検査をおこなっています。
経皮的血管形成術(PTA)について
経皮的血管形成術は、経皮的に動脈を穿刺してその内腔にカテーテルを挿入し、狭窄あるいは閉塞した部分を血管拡張用のバルーンで開大する治療方法です。
治療方法としては、ガイドワイヤーを入れ狭窄部位を通します。血管内を通ったら、そのガイドワイヤーにモノレールのような形でバルーンカテーテルを乗せて添わせ、狭窄部位を通します。ちょうど狭窄部位にバルーンを位置合わせし、バルーンを拡張し、狭窄を押し広げます。30秒~90秒拡張後バルーンを収縮させ、冠動脈内から抜き去り、拡張がうまくいったか造影を行い、問題なければガイドワイヤー及びガイドカテーテルを抜き、終了します。
拡張が不十分な場合には、当院ではその際に通常のバルーンだけでなくNSE(ノンスリップエレメント®)やAGS(アンギオスカルプト®)などの血管に対して解離を最小限に抑えて亀裂を入れるスコアリングバルーンを使用する事もあります。
最近では薬剤溶出性ステント(Eluvia®)や薬剤溶出性バルーン(IN.PACT Adminal® やLUTONIX®)などによって再狭窄率が以前に比べて低くなっており、症例に応じて使い分けています。
また最近は高度に進んだ動脈硬化症に対してcrosser®という血管の石灰を破砕する治療も行っております。

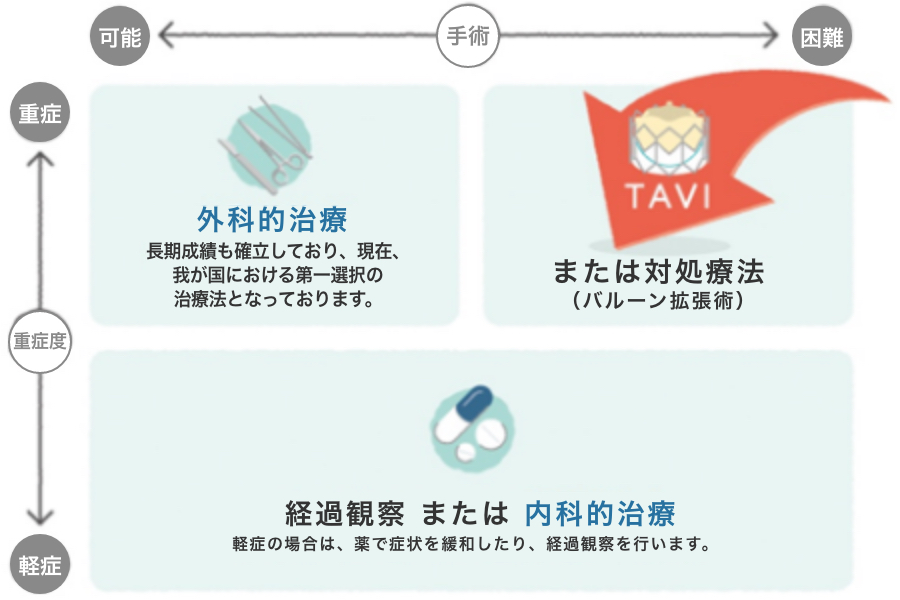
TAVI/TAVR(経カテーテル的大動脈弁植え込み術)
経カテーテル的大動脈弁植え込み術は手術は、これまで手術で必須である心停止・体外循環を行わずにカテーテルを用い生体弁による人工弁を植え込む方法です。対象となる症例は広く、大動脈弁狭窄症の方で過去に心臓手術を受けている方や多臓器疾患を併存しているハイリスクの症例にも根治的治療を可能としています。また、過去に生体弁での外科的大動脈弁置換術を受けている方で、弁機能不全 (狭窄または閉鎖不全) となった場合も、再度外科手術を受けることなくTAVIで治療が可能となっています。
日本では2013年10月から保険適用となり2020年10月までに累計で30,000件以上施行されています。
周術期死亡率は低く、ハイリスク患者を対象にした欧米の他施設ランダム化試験であるPARTNER trialの5年成績でも外科治療と同等の結果が得られています。また、最近では中等度や低リスクの症例に関してもTAVIは外科治療と同等か症例によっては良好な結果も報告されています。一般的に、ハイリスク症例の方においてTAVIは手術と比較し身体的負担の軽減、手技時間の短縮の結果、早期の安静度拡大、リハビリへのスムーズな移行ができ、食事の再開も早いためより多くの症例で早期の独歩退院が得られています。

TAVI治療の特徴
当院では、TAVIを原則、全身麻酔や気管挿管による人工呼吸器管理を行わず、鎮静薬と局所麻酔下で平均手術時間60分程度で行うため、患者さんに負担の少ない低侵襲治療を実践しています。
心臓血管外科、循環器内科、麻酔科、リハビリテーション科、放射線技師、臨床工学技士、看護師からなるハートチームで話し合い、外科治療またはTAVIのどちらで治療するか決定しています。

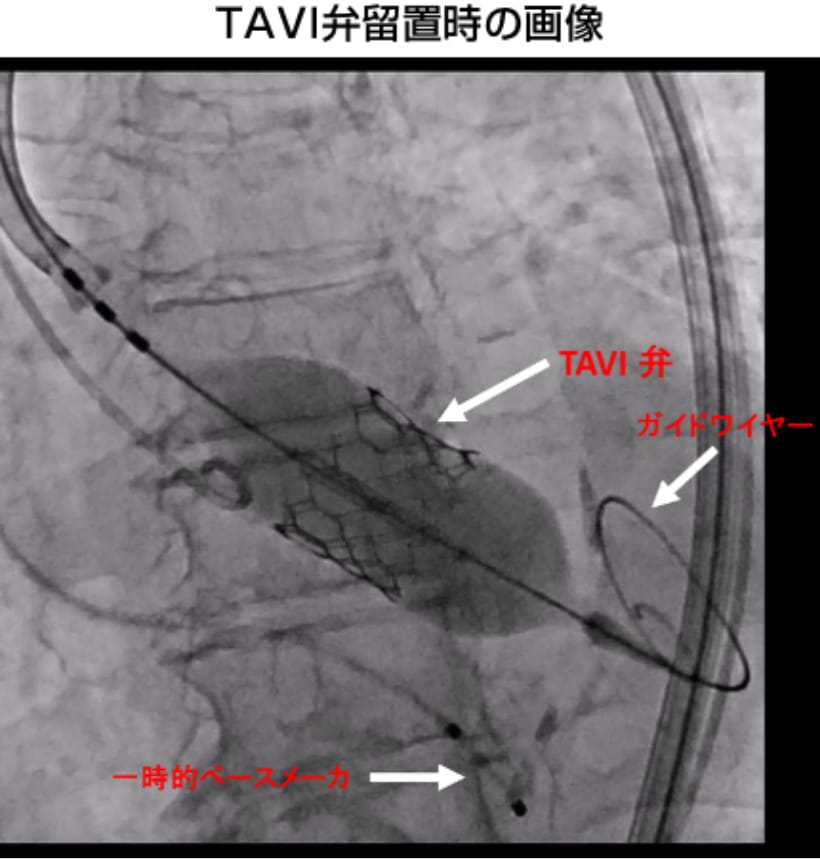
TAVIを用いた症例
乳癌の手術後で膠原病、糖尿病に対しステロイド、インスリン治療を行っている80歳代後半の女性。
大腿動脈よりアプローチして、逆行性に大動脈弁からガイドワイヤーを左心室内へ通過させます。次いで、TAVI弁を収納したカテーテルを持ち込むためのガイドワイヤーに交換し、事前にCTや超音波で解析した至適サイズのTAVI弁を血管造影を行いながら高頻度ペーシング下に留置します。留置後は血圧や脈拍と共に心臓超音波、大動脈弁上造影で確認を行います。
この患者さんも多くの患者同様、翌日には歩行と食事を再開し、早期の独歩退院となりました。
MitraClip(マイトラクリップ)
薬物治療などの内科的治療で改善しない僧帽弁閉鎖不全症の治療法として外科手術があります。
外科手術には患者さん自身の弁や周辺組織を修復する僧帽弁形成術もしくは、人工弁に取り替える僧帽弁置換術があります。
しかし、心停止・体外循環下に行われる外科治療は、過去に心臓手術を受けている方や多臓器疾患を併存している方にとってはハイリスクとなります。このようなハイリスク症例の方への治療を可能としたのがMitraClip®を用いる経皮的僧帽弁接合不全修復術です。
欧州では2008年、米国では2013年に承認を受け世界では5万人以上の患者の治療実績があり日本では2018年4月から保険適用となり治療が開始されました。
経皮的僧帽弁接合不全修復術で使用するMitraClip

ハイリスク症例の方において経皮的僧帽弁接合不全修復術は外科手術と比較し身体的負担の軽減と手技時間短縮の結果、早期の安静度拡大、リハビリへのスムーズな移行ができ食事の再開も早いためより多くの症例で早期の独歩退院が得られています。
当院では心臓血管外科、循環器内科、麻酔科、リハビリテーション科、放射線技師、臨床工学士、看護師からなるハートチームで話し合い外科的治療または経皮的僧帽弁接合不全修復術のどちらで治療するか決定しています。
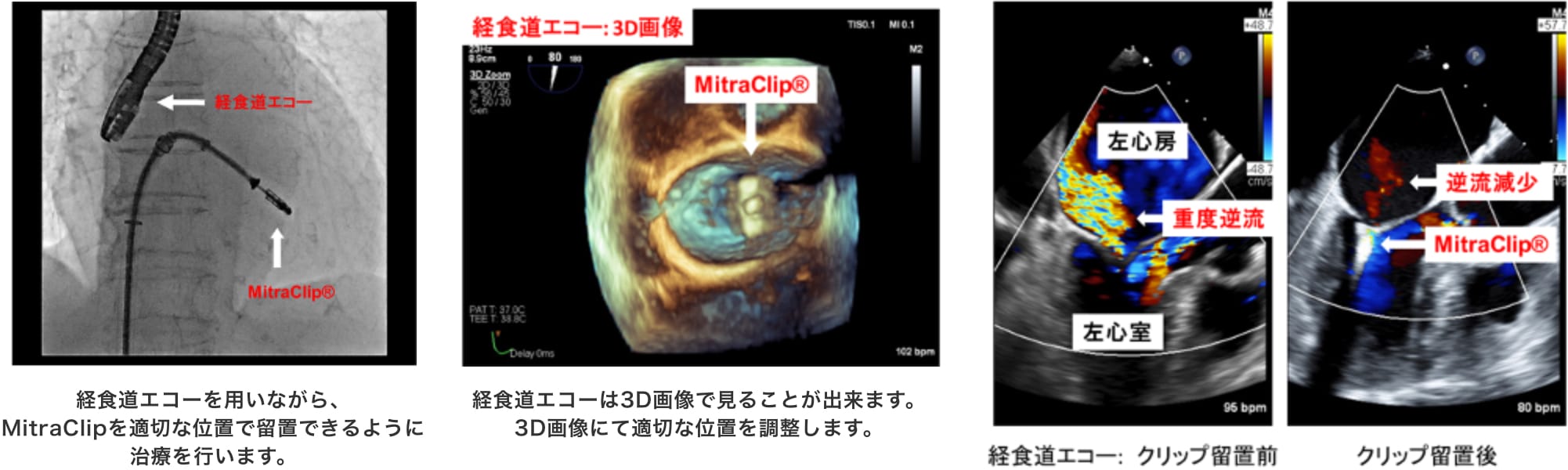
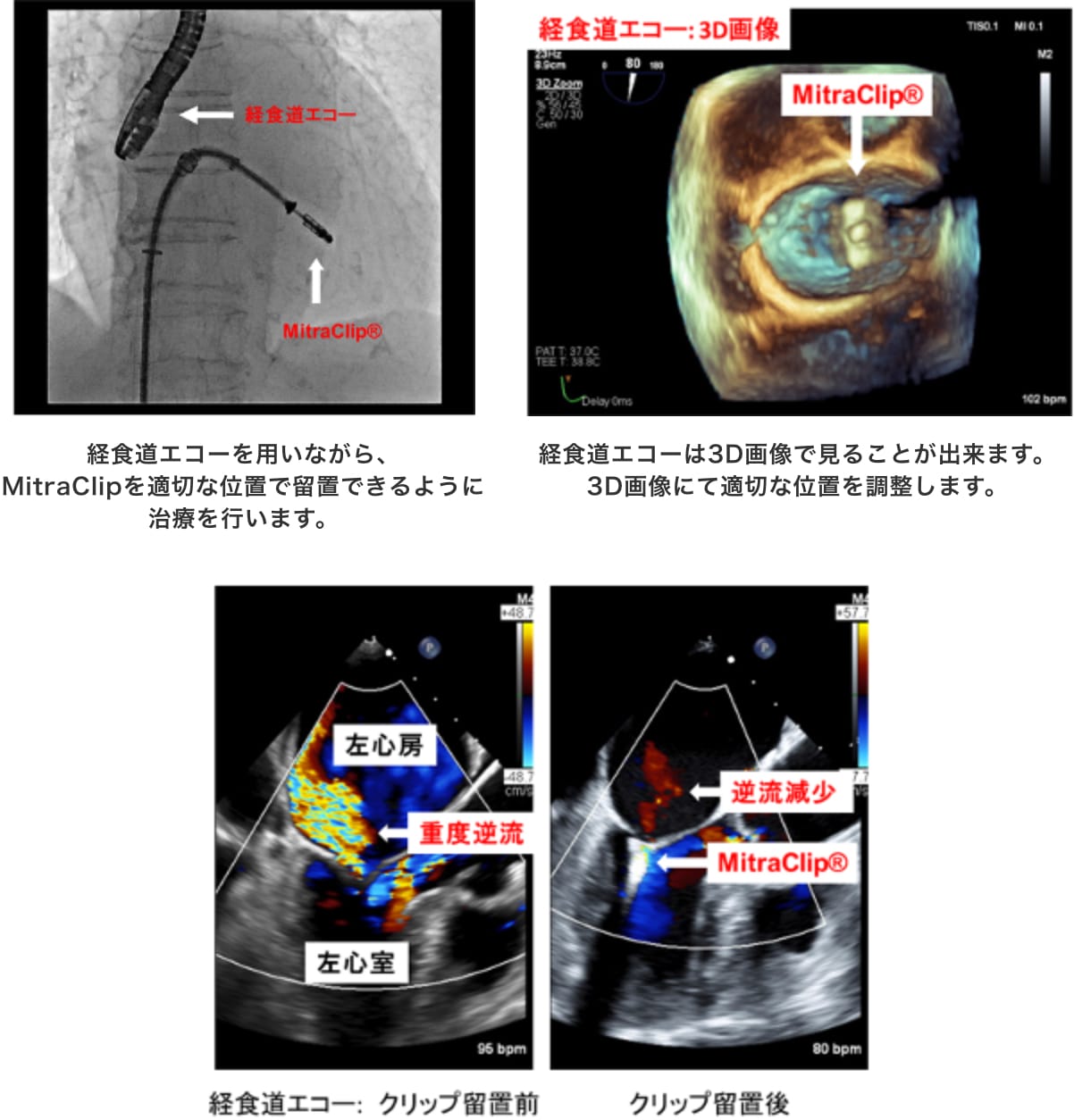
当院でのMitraClip®治療の症例
心不全入院を繰り返している80歳代の男性。
全身麻酔、経食道心エコーガイドで治療を行います。大腿静脈よりアプローチして、心エコーで入念にカテーテル先端を確認しながら心筋中隔穿刺を行うことで右心房から左心房に侵入します。次に、左心房内でクリップを僧帽弁直上まで持ち込み、クリップを開き、接合不全の位置に合わせてから左心室内に侵入し、僧帽弁の両弁尖を把持します。クリップが適切な位置で把持し、逆流を制御できていることや狭窄をおこしていないことなどを3D画像も含め入念に確認した後に最終留置とします。
原則、静脈アプローチのみで造影剤も使用せずに行う手技であるため患者さんの負担は最小限であり、翌日には歩行、食事を再開し、早期退院が可能です。
その他カテーテル治療
以下をクリック頂くと各治療の説明に移動します。
経皮的心房中隔欠損閉鎖術(ASD閉鎖術)
先天性心疾患の約7%を占めるとされている心房中隔欠損症(ASD: Atrial Septal Defect)に対するカテーテル閉鎖術(経皮的心房中隔欠損閉鎖術)は、2017年末までに国内で約9700例の症例で行われており、2019年時点で国内77施設が認定を受けており、治療を受けることが可能となっています。
(JPIC HP: 2019年ASD認定施設:http://www.jpic-meeting.org/cathe/asd/inst2019.shtml)
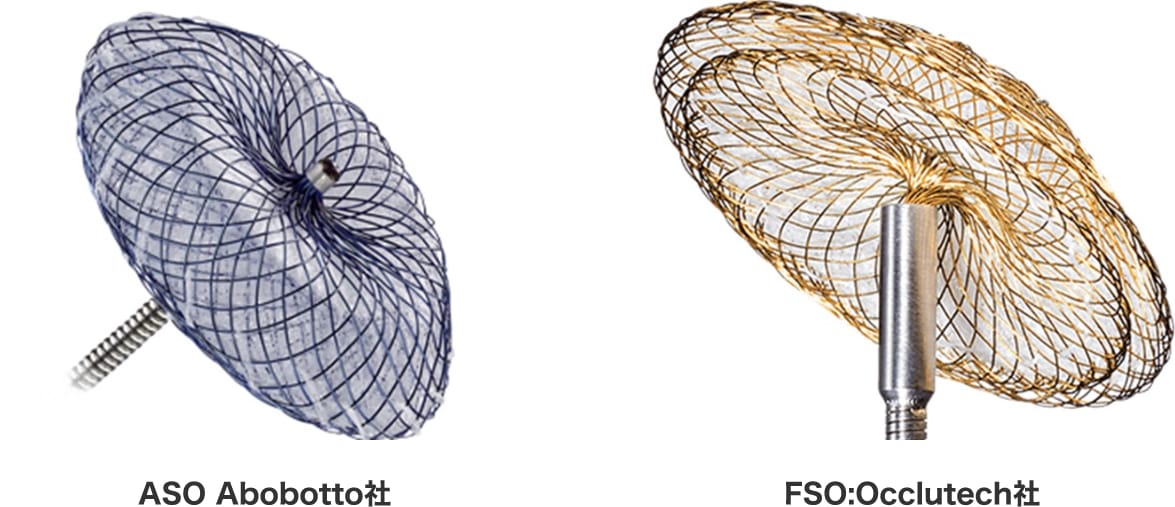
2005年に日本国内でAmplatzer Septal Occluder(ASO)の輸入承認が得られ、2006年4月から保険償還されて使用されていましたが、2016年よりFigulla Flex-Ⅱ(FF-Ⅱ)が保険償還となったことで、より多くの症例でカテーテルによる治療を行うことが出来るようになっています。両者にそれぞれ特徴があり、当院では、ASDの形態やサイズ・心房中隔長や周囲のリムの状態を見て使い分けています。
当院では2013年よりこの治療を開始しており、従来からの外科治療と異なり、より低侵襲な治療で欠損孔閉鎖が可能となっています。国内での治療による死亡例は無く、これまでに行われた症例のうち、2017年末までの国内症例で脱落(留置した閉鎖栓がはずれてしまう)0.43%、erosion(心臓周囲へのデバイス圧排に伴う出血)0.15%と、海外で報告されている合併症の頻度と比べて、きわめて低率で行われており、安全かつ有効な治療法として広く認知されています。
ASDの病態
新生児期小児期での肺体血流比(Qp/Qs)高値例では、早期に右心不全から肺高血圧へと移行するため、Eisenmenger化(左→右シャントは減少して右→左シャントへ移行)する前に外科的修復を受けることが多くなっています。小児例でも左→右への短絡量が少なければ、学童期を待って修復(多くは経皮的に閉鎖栓を用いて修復)をすることが可能です。
また、成人例の多くは生下時より欠損孔があるため、日常生活の不都合を感じていないことが多いのが特徴です。成人例の一部の方々は、小児期より欠損孔の開存を知らされていることもあるが、気づかれずに成人を迎えていることも多く、健診時の心電図異常や胸部レントゲンの異常で初めて指摘されることもしばしばです。
小児期の左→右短絡が少量であっても、長期の右房・右室容量負荷により、右心系の拡大が生じると、欠損孔の拡大に伴う短絡量の増大が見られるようになり、Qp/Qsの上昇を認めるようになります。また、心房負荷に伴い上室性期外収縮が頻発したり、心房細動へと移行することがあり、心房細動例では抗凝固療法が終生必要となります。ASDが原因の場合は、まず心房細動のカテーテルアブレーション後に、Septal Occludeを用いて欠損孔を閉鎖することで心房細動の再発の可能性は極めて低くなります。
また、このような時期を経てなお放置すれば、将来的には肺高血圧症から右心不全へと発展して、予後不良となる可能性があるため注意が必要です。
カテーテル閉鎖術の適応基準
- 二次孔心房中隔欠損
- 欠損孔の径が38mm以下の患者
- Qp/Qsが1.5以上、または容量負荷による右室の拡張がある
- 欠損孔辺縁から冠静脈洞、房室弁、右上肺静脈までの距離が5mm以上
当院では、ASDの疑いで紹介された患者さんは、経胸壁心臓超音波検査および経食道心臓超音波を行って欠損孔の有無・欠損孔周囲のリムの測定・心房中隔のサイズ測定などを検討し、判断が難しい症例では、CTスキャンによる評価も追加することで、カテーテルによる治療が適しているのか、外科手術が適しているのかを総合的に判断して対応しています。
閉鎖栓(Septal Occluder)を用いた症例
60代男性で自覚症状は無し。
30代で検診の際に心電図異常と聴診上のⅡ音固定性分裂・収縮期雑音(LevineⅠ/Ⅵ)により、ASDが疑われて他院でカテーテル検査施行歴がある。その際にASD手術適応と言われたが、自覚症状もないため経過観察を希望され、未治療であった。
その後、60代となって血圧軽度上昇を指摘された際に近医で心臓超音波を施行され、再度カテーテル検査を勧められて他院へ紹介入院。その際にQp/Qs 3.24と著明高値のため、経皮的心房中隔欠損閉鎖術の目的で、当院へ紹介となった。
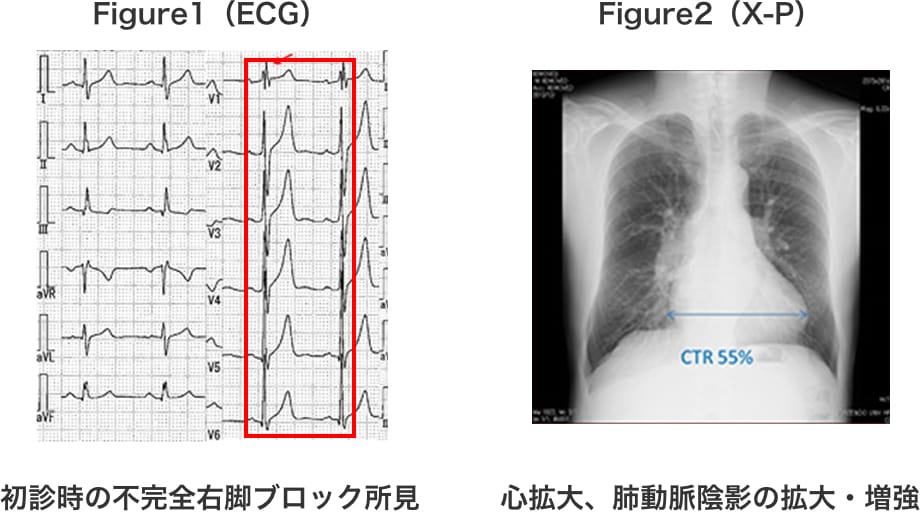
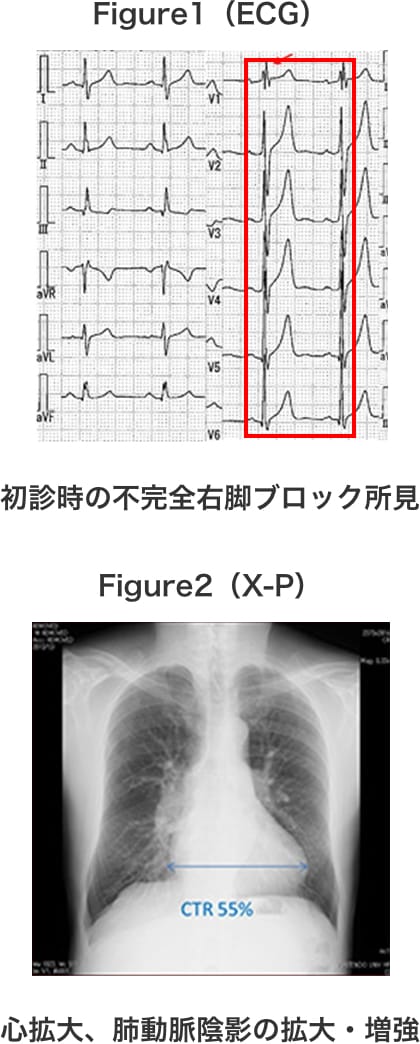
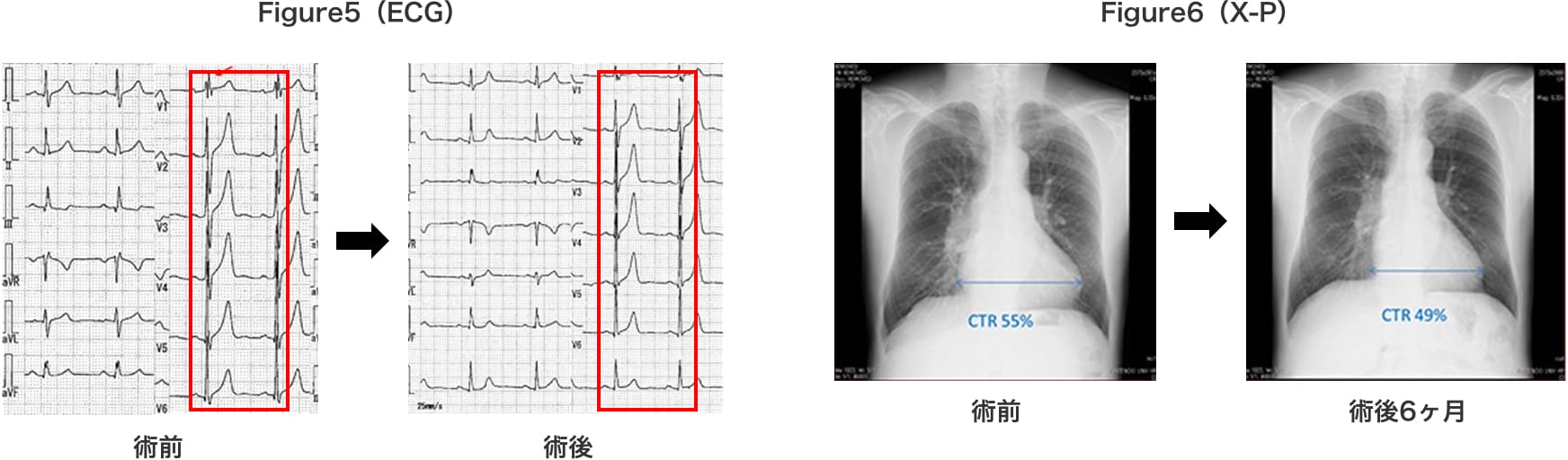
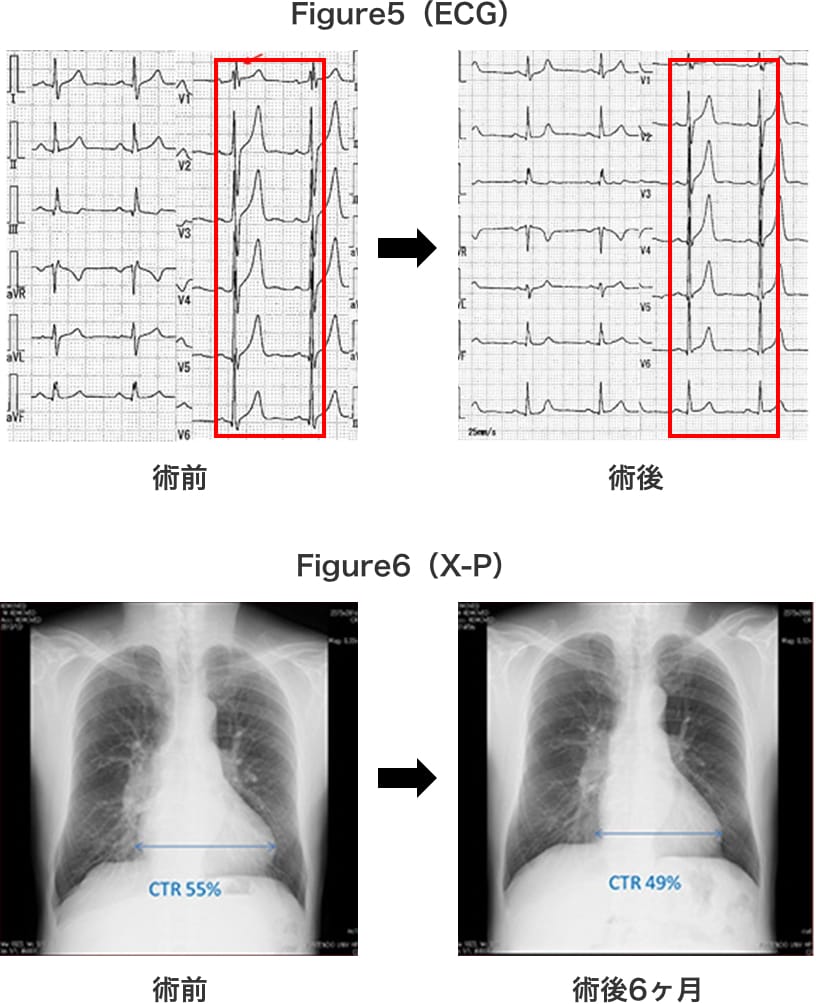
当院初診時、自覚症状はないが心電図上の不完全右脚ブロック所見(Figure1)、胸部X-P上の心拡大と肺動脈陰影の拡大・増強を認めた。(Figure2)
また、当院でのTTE(経胸壁心臓超音波)上のQp/Qsは、2.0であった。
TEE(経食道心臓超音波)では、心房中隔欠損孔20×24mmの二次孔欠損型ASDを認め、Aorticリムは一部欠損しており最大部位も4mmと薄かったが、他の欠損孔周囲のリム径は十分であると判断された。(Figure4 左)
術中の、サイジングバルーンによるstop flowは、24mmで得られ(Figure3 左)、24mmのASOデバイスを留置しようとしたが、Aortic リムが広範に薄いことにより留置が困難であったため、最終的にはハウスドルフシースを使用して25mmサイズのASOが留置可能であった。(Figure3 右)
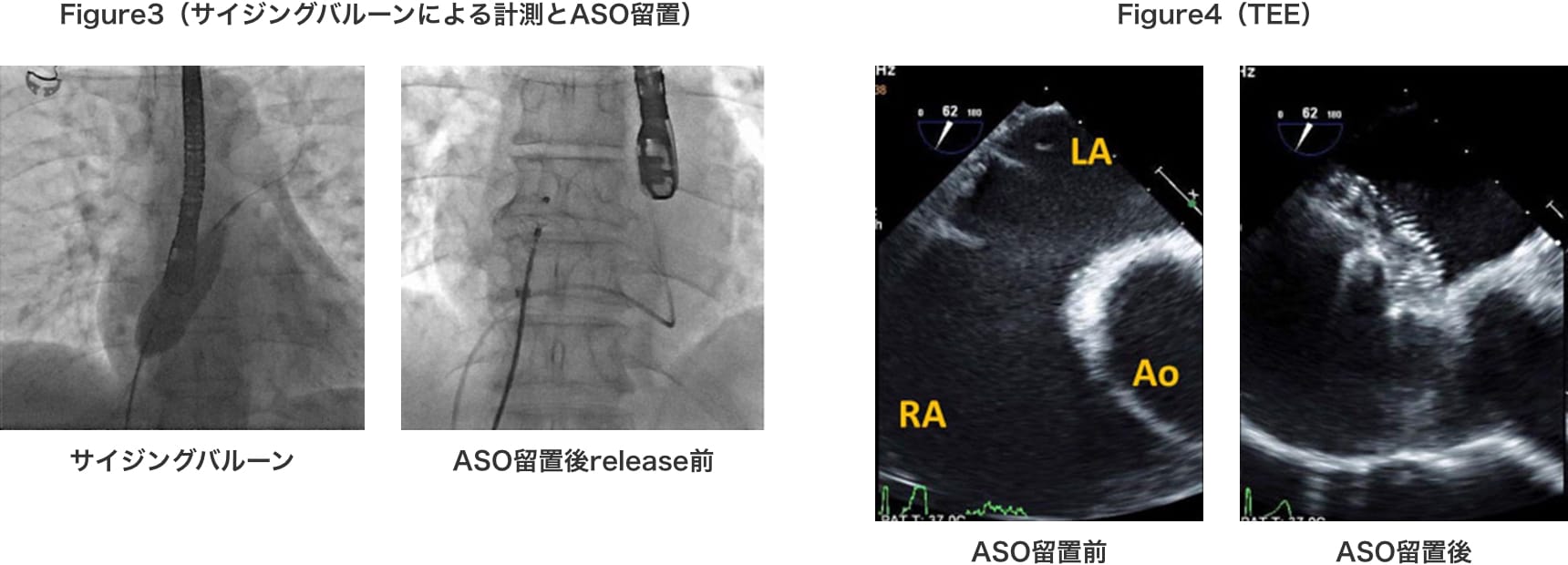
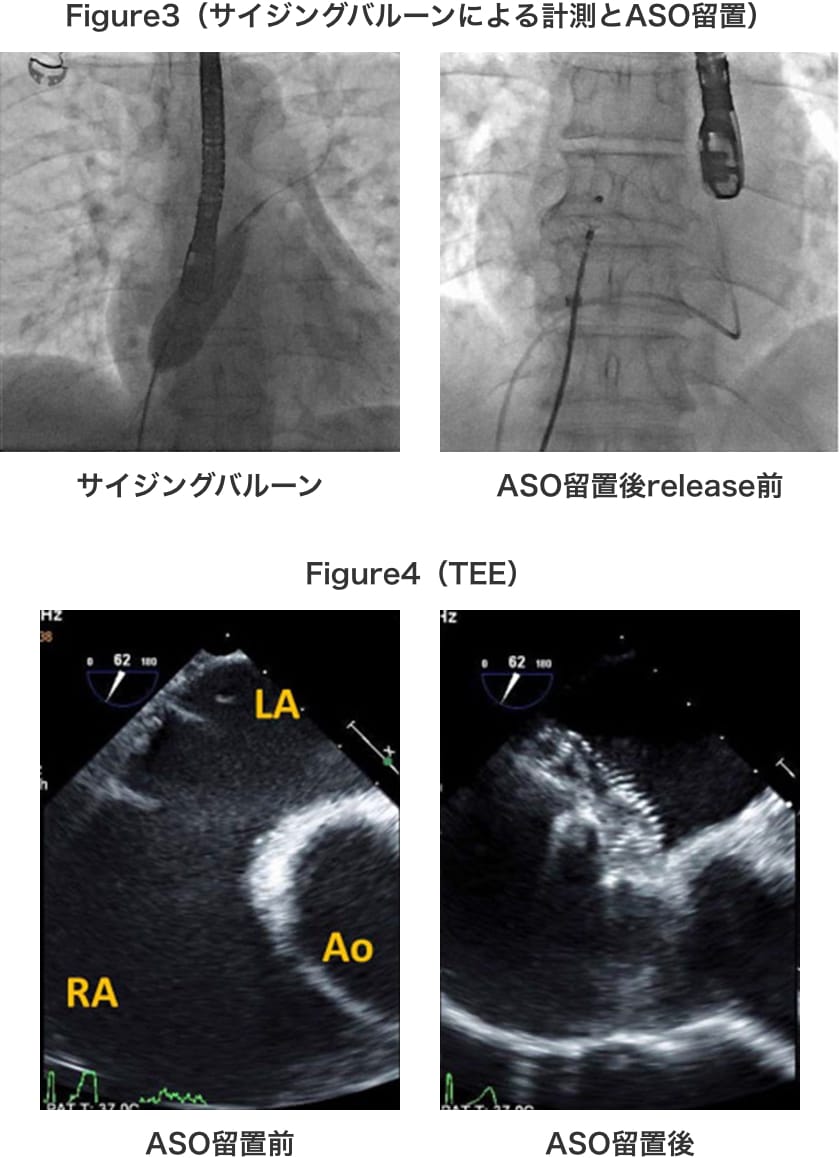
術中のTEEではデバイスが全周のリムを十分に挟んでいること、L→R shuntの消失とデバイスの心臓周囲への圧排が無いことを確認し、wiggleにより脱落のリスクが無いことを確認後にデリバリーケーブルからreleaseした。
術後経過は良好で、自覚症状は術前に認めなかったが、運動耐用能が自覚的にも著明に上がっており、術後6カ月のfollow upの心電図では不完全右脚ブロックの消失(Figure5 右)と、胸部X-P上の心陰影の縮小を認めた。(Figure6 右)
経皮的動脈管閉鎖術(PDA閉鎖術)
先天性心疾患の約10%に認めるとされている動脈管開存症(PDA: Patent Ductal Arteriosus)に対するカテーテル閉鎖術(経皮的動脈管閉鎖術)は、2008年12月にAmplatzer Duct Occluder(ADO)が国内で承認され、2009年より治療が開始となっており、2017年末までに国内で約1800例の症例で行われています。2019年時点で国内65施設が認定を受けており、治療を受けることが可能となっています。
JPIC HP: 2019年ASD認定施施設
http://www.jpic-meeting.org/cathe/pda/inst2019.shtml

PDAの病態
PDAは胎生期に臍帯血が大動脈へと流れるための重要な役割を示していたが、生後呼吸を開始するとともに、肺動脈圧の低下から閉鎖に至るはずの動脈管が持続的に開存しているもので、早産の特に低出生体重児に多く認められ、女児に2倍多いと報告されている。
他の心臓奇形を合併することも多く、PDAのサイズや他の心血管の病態が全身への影響を決定する。PDAの大動脈→肺動脈の短絡量が多いと肺高血圧を生じて肺血管床の障害が起きることで肺血管抵抗が上昇、やがて右心負荷を生じて右心不全に陥る。また、心房負荷の増加で不整脈を生じるようになったり、弁膜症同様にシャント部に感染性血管炎を生じると重篤である。
カテーテル閉鎖術の適応基準
- 動脈管の最小経が2.0mm以上、12mm以下であること
2.0mm未満-コイル閉鎖
2.0mm~12mmーAMPLATZER動脈管オクルーダー
12mm以上ーデバイス以外の手段による閉鎖 - 肺血管抵抗(PVR)8単位未満、もしくは肺体血管抵抗比(Rp/Rs) 0.4 未満
- 2019年1月より従来のADO-Ⅰに加えて、ADO-Ⅱの販売が開始となり様々な形態のPDAに対して経皮的閉鎖術の治療が可能となり、2020年4月1日からは、PICCOLOオクルーダーの販売が開始され、生後3日以上かつ体重700グラム以上の低体重児にも治療が可能となりました。
当院では、PDAで紹介された患者さんは、経胸壁心臓超音波による心負荷の評価に加えて、造影CTスキャンを行って形態およびPDAサイズの評価を事前に行い、カテーテルによる治療が適しているのか、外科手術が適しているのかを総合的に判断しております。また、既に肺血管抵抗の高くなった症例では、サイズ・形態に関わらず外科的修復の適応となりますので、心臓血管外科での修復を依頼します。
閉鎖栓(Duct Occluder)を用いた症例
日齢19で心雑音指摘され、経胸壁心臓超音波でPDAを指摘されていた患者。
1歳時に当院紹介され、心臓カテーテル検査の結果、Qp/Qs 2.5と高値を認め、閉鎖術の適応と診断。術前に心不全徴候を認め、利尿薬を開始して心不全コントロールを行い、待機的ADO留置術を行った。
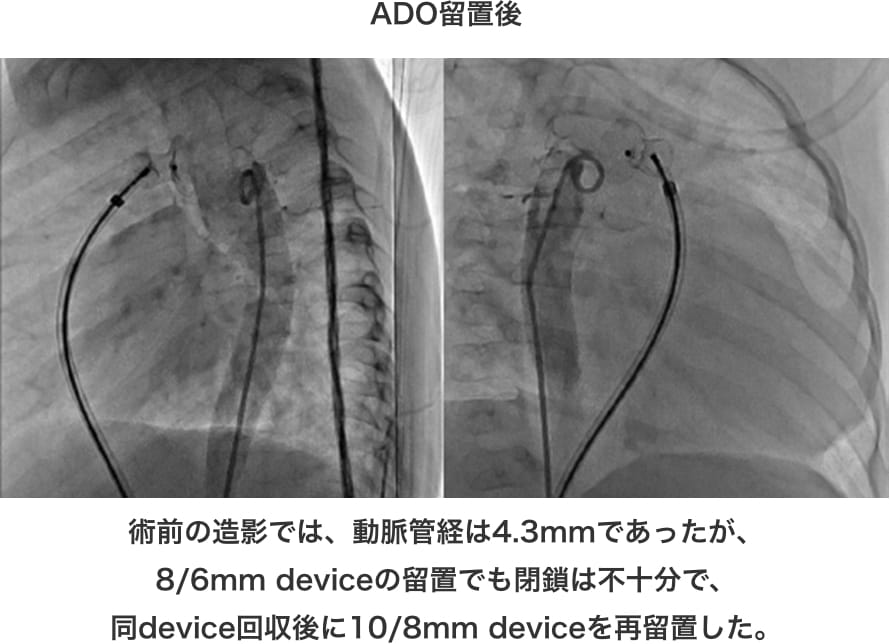
経皮的卵円孔閉鎖術(PFO閉鎖術)
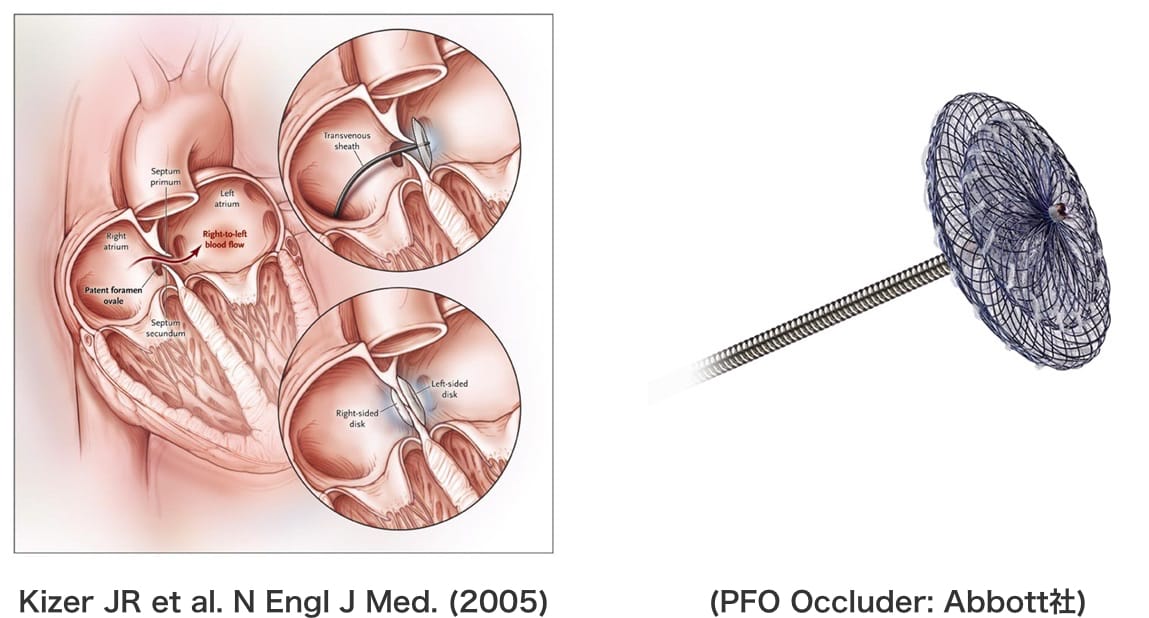
卵円孔開存(Patent Foramen Ovale: PFO)について
胎生期に胎盤を経由して母体から供給される動脈血を、右心房から左心房を経て脳や全身へと導く重要な役割を担う卵円孔は、出生後の肺呼吸開始に伴う肺血管抵抗の低下と肺血流増加による左房圧上昇によって自然に閉鎖する。しかし、なかにはこの卵円孔が閉鎖せずに弁のようになって、開いたり閉じたりする状態を卵円孔開存症と呼び、健康な成人の20~25%にあると言われています。
PFOによって生じる塞栓症の病態
通常の状態では卵円孔開存があっても血液の漏れは起こらず、何も問題は起きません。 しかし、ある特定の状況(腹圧のかかる状況,咳嗽や排便時など)では、右心房の圧力が一時的に上昇することで、卵円孔が開いてわずかな血液の漏れが起こることがあります。この時に静脈の中にある小さな血栓が卵円孔を通過して左心房に流れこみ、さらに頭の血管に到達すると頭痛やめまい、視野異常(暗黒感,輝き)がおこります。血栓が大きい場合には、動脈の塞栓症を生じ、時として脳梗塞を起こします。重症の場合には手足の麻痺や言語障害などの後遺症を残すことがあります。このような脳梗塞は奇異性塞栓症と呼ばれ、他の原因(高血圧、糖尿病、脂質異常、心房細動など)による脳梗塞と区別しています。奇異性脳塞栓症は、比較的若い年齢(40歳前後)の成人に多いことも特徴です。従来は、奇異性塞栓症の再発予防に抗血栓療法が行われてきましたが、PFO閉鎖栓を用いる経皮的閉鎖栓の留置がより有効であることがわかりました。
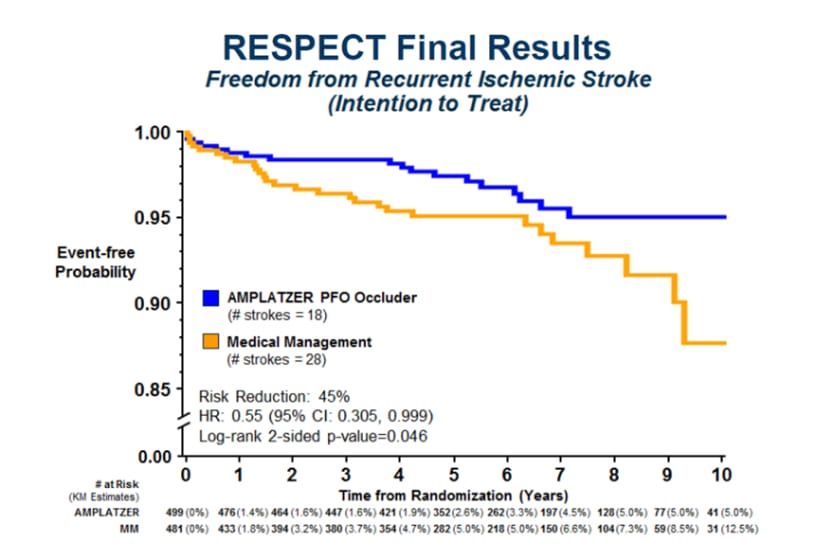
Amplatzer PFO閉鎖栓が世界で承認されたランドマーク研究の結果では、虚血性脳卒中全体の再発は、抗血栓療法内服に比べて閉鎖栓施行群で10年間の経過観察中45%に減少効果が認められ(左図)、原因不明な虚血性脳卒中においては、62%もの減少効果が得られた。(右図)

カテーテル閉鎖術の適応基準
必須条件
- 卵円孔開存の関与があり得る潜因性脳梗塞の診断に合致
- 閉鎖術施行後一定期間の抗血栓療法が可能と判断される
- 原則として60歳未満
- 妊娠していない、かつ1年以内の妊娠希望がない(女性の場合)
推奨基準
- 適切に施行された抗血栓療法中に潜因性脳梗塞を発症したもの
- 機能的・解剖学的に高リスクの卵円孔開存を有するもの(下記いずれか)
a. シャント量が多い
b. 心房中隔瘤(atrial septal aneurysm)の合併
c. 下大静脈弁(Eustachian valve)の合併
d. キアリ網(Chiari network)の合併
e. 安静時に右→左シャントを有する(バルサルバ負荷(-))
f. 長いトンネルを有する卵円孔開存
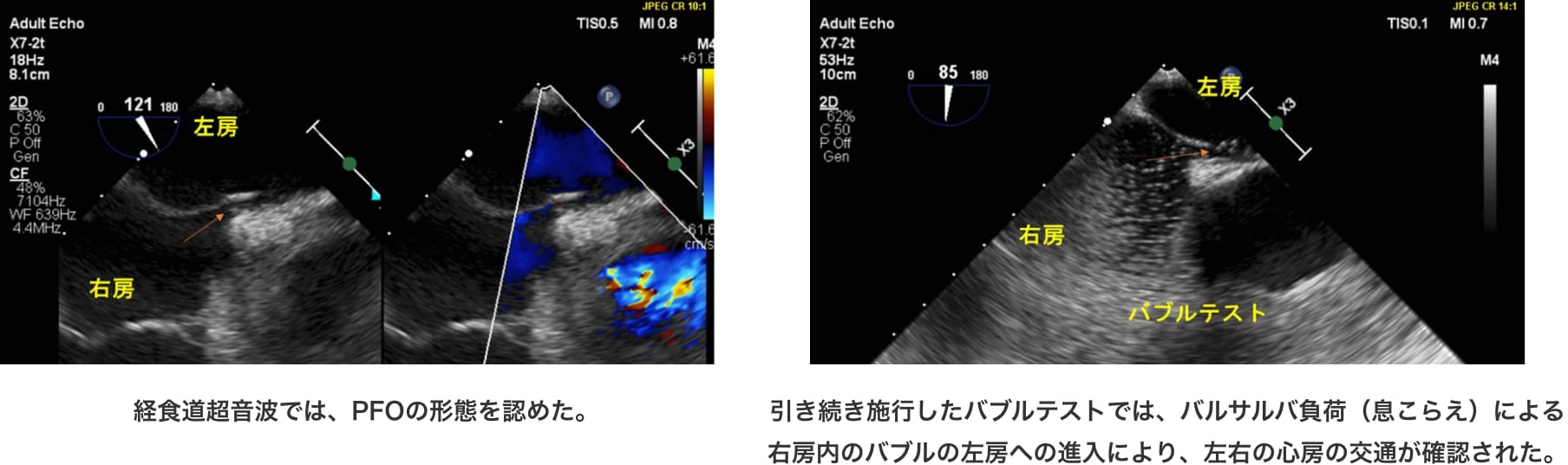
当院では、奇異性塞栓症・潜因性脳梗塞の原因が、PFOによるものと疑われて紹介された患者さんは、経胸壁心臓超音波および経食道超音波による形態評価とバブルテスト(息こらえによる右心房→左心房へのシャントの証明)による評価に加えて、脳梗塞の局在や頭頚部動脈の評価、血液凝固異常の有無や心房細動などの不整脈の有無など、この治療の必要性・有益性について評価を行い、ブレインハートチームの協議を経て、閉鎖術を施行しています。
閉鎖栓(PFO Occluder)を用いた
局所麻酔下心腔内エコーガイドの症例
生来健康な50代男性、夜間就寝中に目覚めたところ、左側へ転倒するため脳神経内科受診。
MRI上、急性期梗塞の所見を認め、精査を行ったところ経食道超音波でPFOを指摘され、PFO閉鎖の目的で当科へ紹介となった。
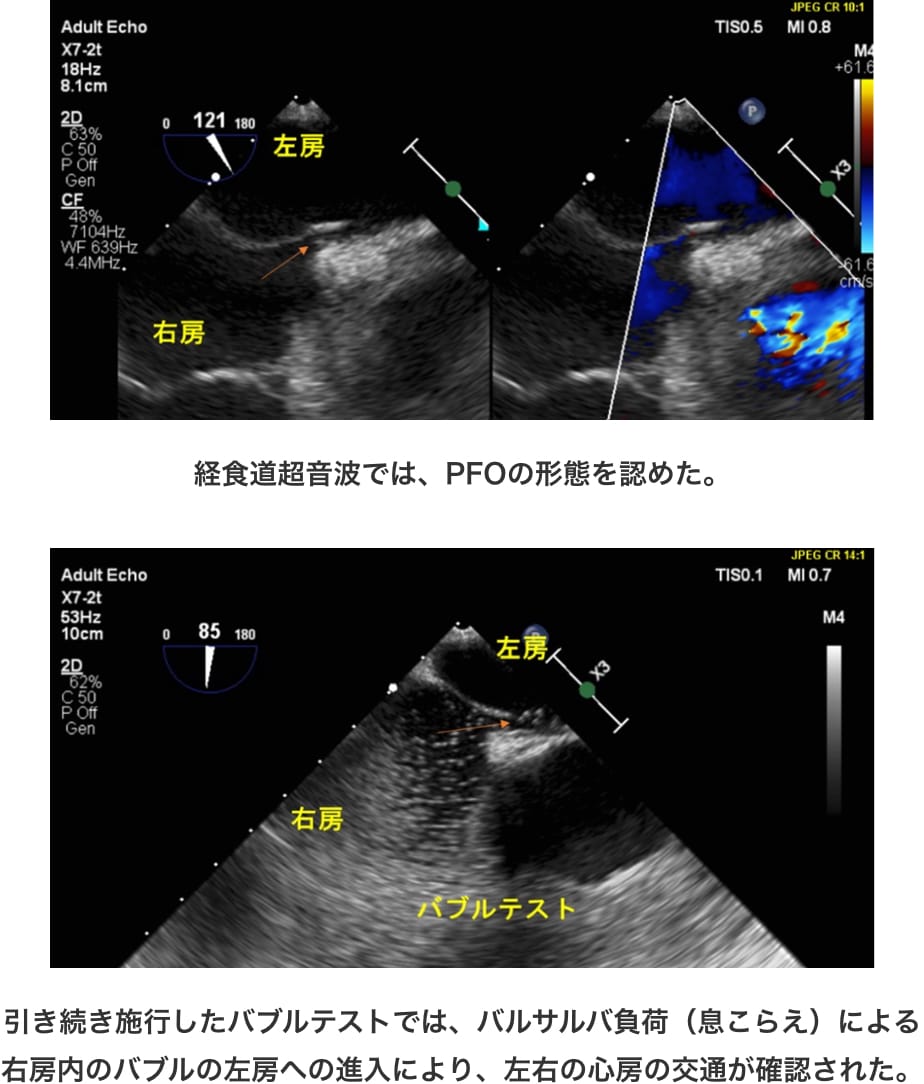
局所麻酔下PFO閉鎖術の実際
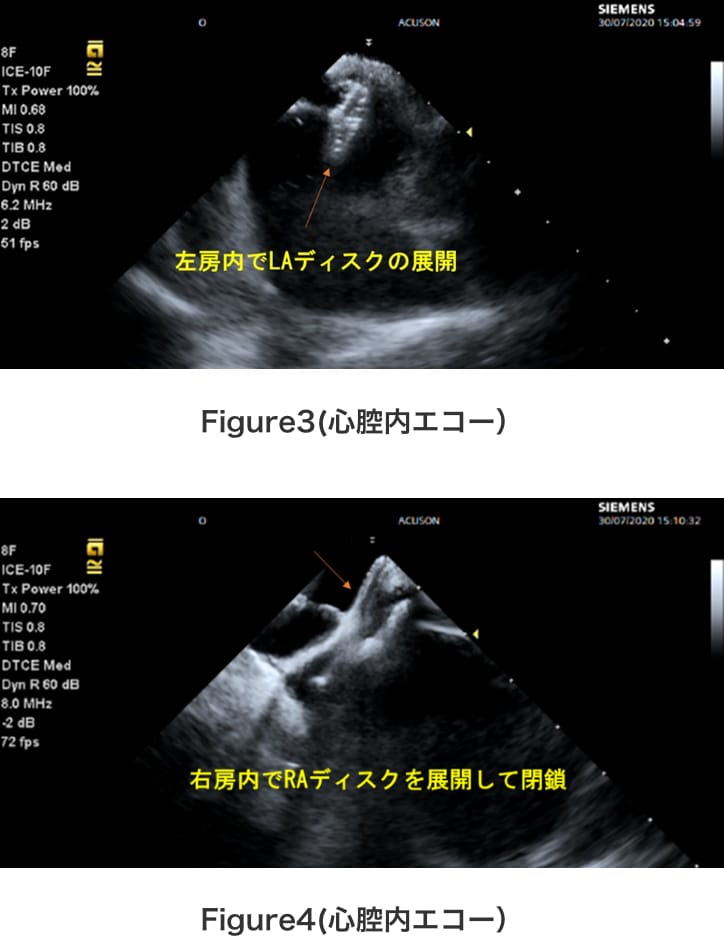
大腿静脈からのカテーテルを、PFOのスリットを介して右房から左房へと進めると、心腔内エコーでドップラー上の左→右シャント血流が認められる。(Figure1) 次いで、サイジングバルーンによりPFOのトンネル長を測定して使用する閉鎖栓のサイズを決定する。(Figure2)
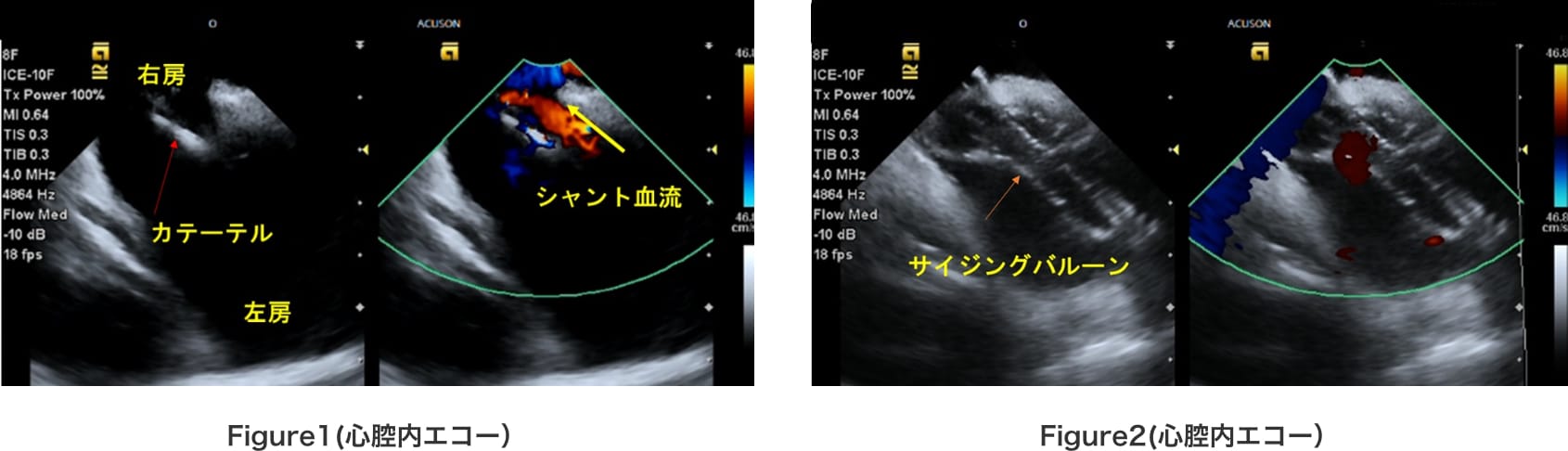
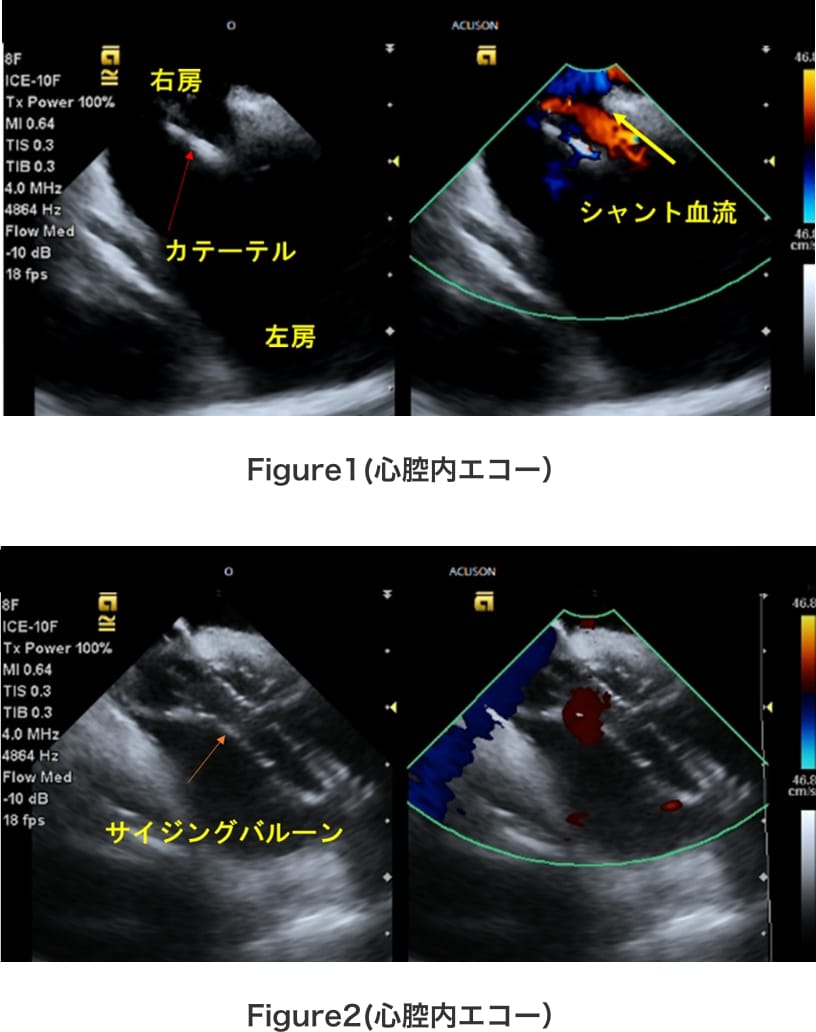
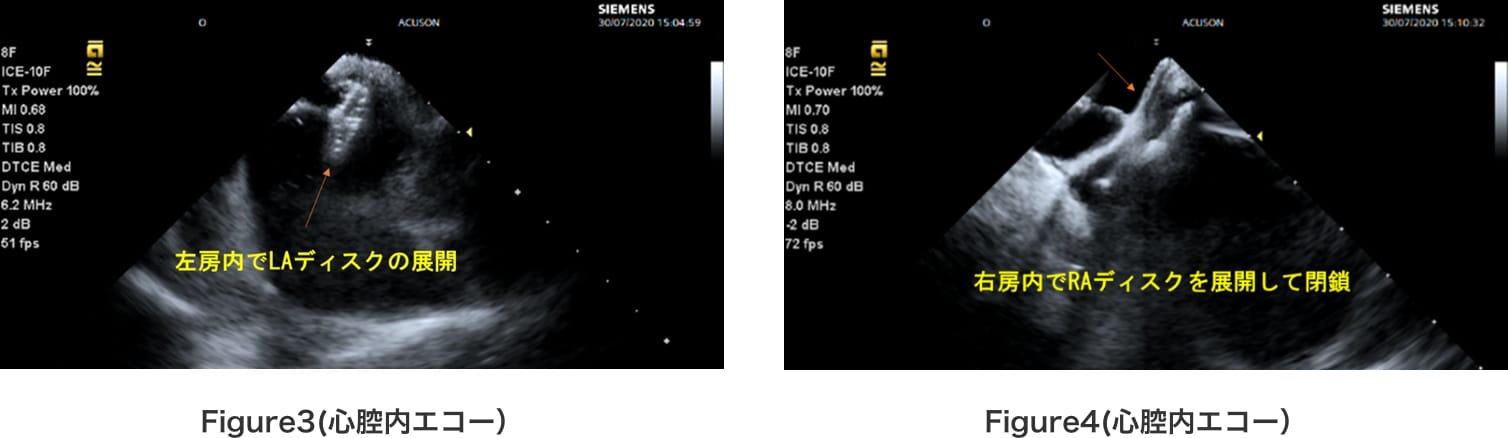
デリバリーシースを左房内へ進めて、LAディスクを左房内で展開して(Figure3)、RAディスクを右房内で展開すれば、PFOの閉鎖が完了となる。(Figure4)
経皮的左心耳閉鎖術(LAA Closure)
Coming Soon(2020年11月施設認定申請中)

冠動脈・SHDの研究グループについて
冠動脈・SHDの研究グループの土肥、岩田の研究者としてのこれまでの歩み・現在取り組んでいる研究など冠動脈・SHDグループの研究内容もご覧ください。




